Beyond Use Date Sediaan Steril
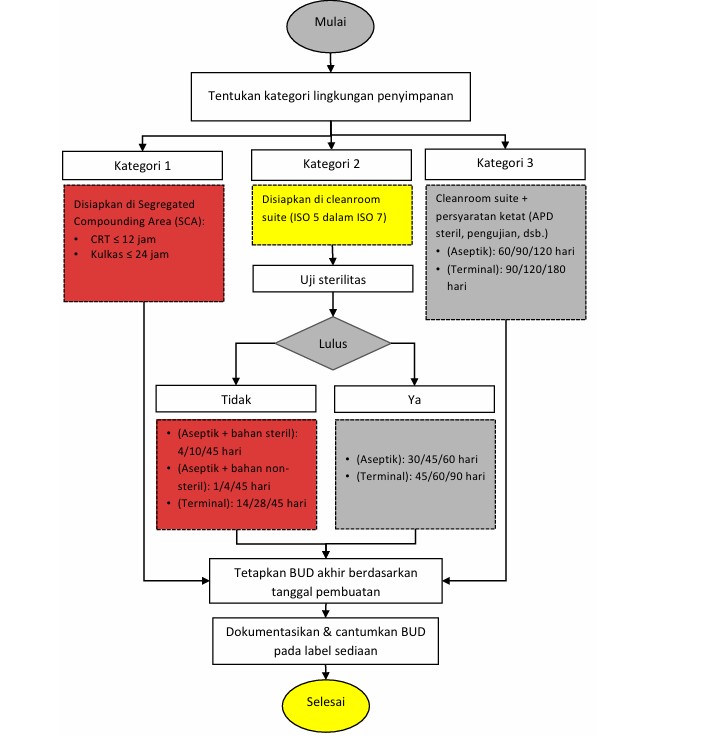
1. Kategori Lingkungan (Category 1, 2, 3)
· Kategori 1: CSP dibuat di Segregated Compounding Area (SCA), area dengan kontrol lingkungan dasar tanpa cleanroom suite penuh. Karena tingkat perlindungan lebih rendah, risiko kontaminasi mikroba lebih tinggi, sehingga BUD sangat pendek.
· Kategori 2: CSP dibuat di cleanroom suite (PEC ISO 5 dalam buffer room ISO 7), sehingga memiliki kontrol lingkungan yang lebih baik dan BUD lebih panjang tergantung pada metode pembuatan dan pengujian.
· Kategori 3: Seperti Kategori 2, tetapi dengan proses penjaminan mutu yang lebih ketat, termasuk APD steril, desinfeksi intensif, pengujian sterilitas dan endotoksin untuk setiap batch. Ini memungkinkan BUD terpanjang.
2. Metode Compounding
· Aseptik: Proses pembuatan di mana semua bahan awal sudah steril dan seluruh tahapan dilakukan dalam kondisi aseptik tanpa langkah sterilisasi akhir.
· Terminal Sterilization: Proses pembuatan di mana produk disterilisasi setelah seluruh proses compounding selesai, biasanya melalui panas atau penyinaran. Metode ini memberikan BUD lebih panjang karena risiko kontaminasi pasca-sterilisasi lebih kecil.
3. Pengujian Sterilitas
Pengujian laboratorium yang memastikan bahwa sediaan bebas dari mikroorganisme.
· Dilakukan & Lulus: Hasil pengujian menunjukkan tidak ada kontaminasi mikroba → BUD dapat diperpanjang sesuai panduan.
· Tidak Dilakukan / Tidak Lulus: BUD harus lebih pendek untuk meminimalkan risiko kontaminasi.
4. Asal Bahan
· Bahan Steril: Semua bahan awal sudah steril → risiko kontaminasi lebih rendah → BUD relatif lebih lama.
· Bahan Non-Steril: Termasuk bahan yang perlu disterilisasi selama atau setelah proses → risiko lebih tinggi → BUD lebih pendek jika tidak diuji sterilitas.
5. Suhu Penyimpanan
· CRT (Controlled Room Temperature): 20–25 °C (suhu ruang terkontrol).
· Kulkas (Refrigerated): 2–8 °C.
· Freezer: −25 hingga −10 °C.
BUD berlaku hanya jika kondisi penyimpanan ini dijaga secara konsisten. Penyimpanan di luar rentang suhu dapat memperpendek masa simpan.
6. Hari yang Dimaksud pada Tabel BUD
- Semua satuan waktu yang disebutkan (1 hari, 4 hari, 45 hari, 90 hari, dst.) dihitung sejak waktu compounding selesai dilakukan (time zero).
- “Hari” berarti hari kalender penuh, bukan hari kerja.
- Jika compounding selesai pada pukul 10.00 tanggal 1 Oktober, maka:
- 1 hari BUD: hingga pukul 10.00 tanggal 2 Oktober
- 4 hari BUD: hingga pukul 10.00 tanggal 5 Oktober
- Dan seterusnya.
7. Dokumentasi BUD
Setiap penetapan BUD harus didukung dokumentasi tertulis, meliputi:
· Kategori lingkungan
· Metode pembuatan
· Hasil uji sterilitas (jika dilakukan)
· Suhu penyimpanan yang ditetapkan
· Perhitungan tanggal BUD final
Hal ini diperlukan untuk kepatuhan terhadap USP ⟨797⟩ dan audit mutu farmasi.
Tips Praktik Baik:
- Selalu pilih BUD terpendek antara hasil perhitungan tabel dan kedaluwarsa bahan terpendek yang digunakan.
- Jika terjadi deviasi (mis. suhu penyimpanan tidak stabil, ruang bersih tidak memenuhi standar), BUD harus dikoreksi lebih pendek sesuai hasil analisis risiko.
Berita Terkait
Menyusun Kriteria Inklusi dan Eksklusi dalam Penelitian Farmasi
Dalam dunia riset farmasi, baik itu di laboratorium, uji praklinis pada hewan, maupun studi klinis k...
Penurunan Kadar Albumin dan Asites
Penurunan kadar albumin dalam tubuh manusia sering kali dikaitkan dengan berbagai kondisi medis yang...
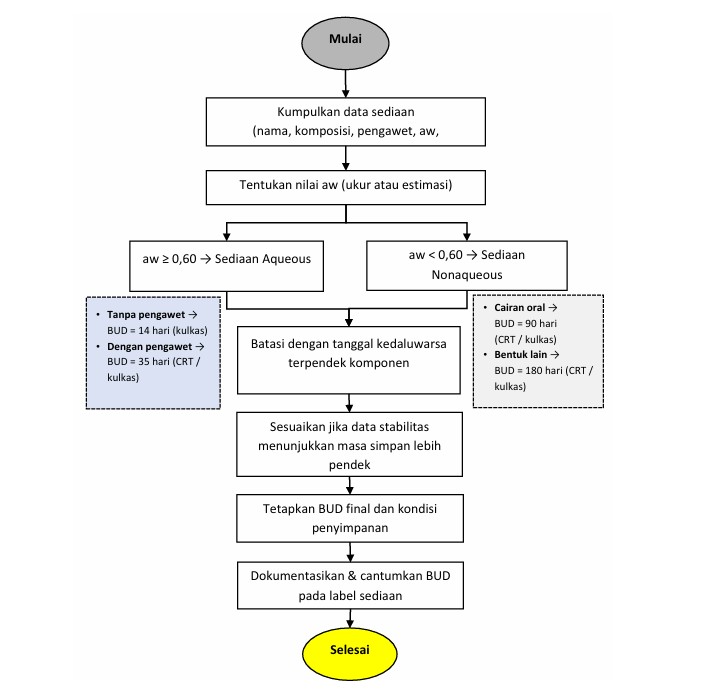
Beyond Use Date Sediaan Non-Steril
1. Beyond-Use Date (BUD) Tanggal batas penggunaan setelah sediaan selesai diracik. Setelah melewati...
Contoh Resep Obat Injeksi
1. Resep Vial Antibiotik (IV Bolus) Kasus: Pasien infeksi bakteri memerlukan injeksi Ceftriaxone....